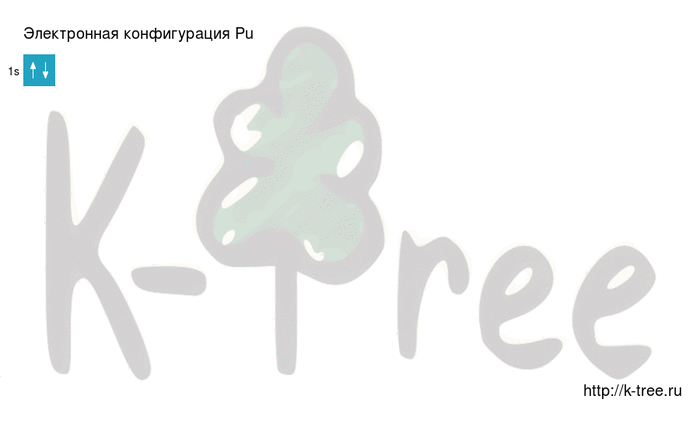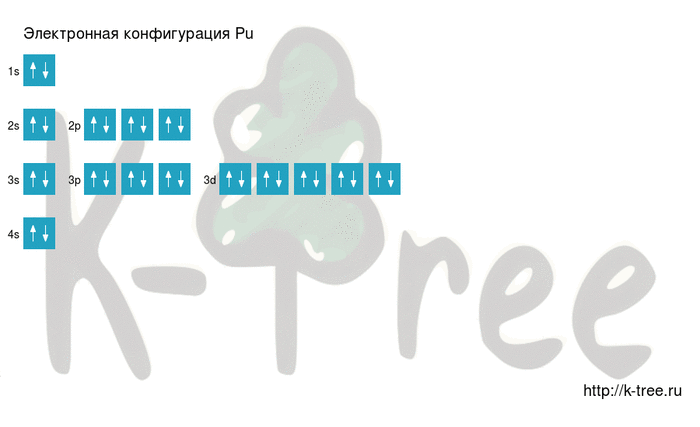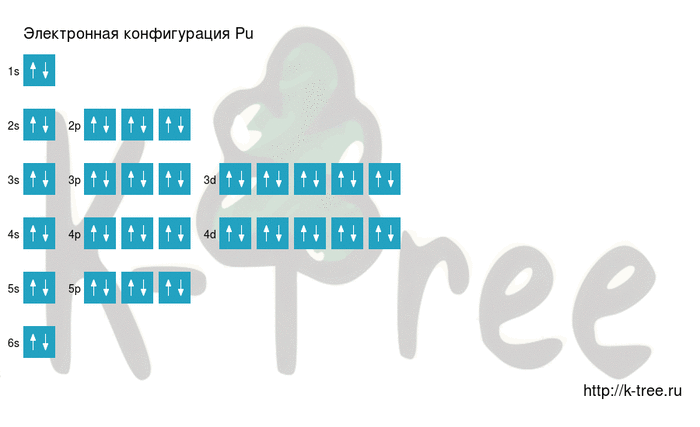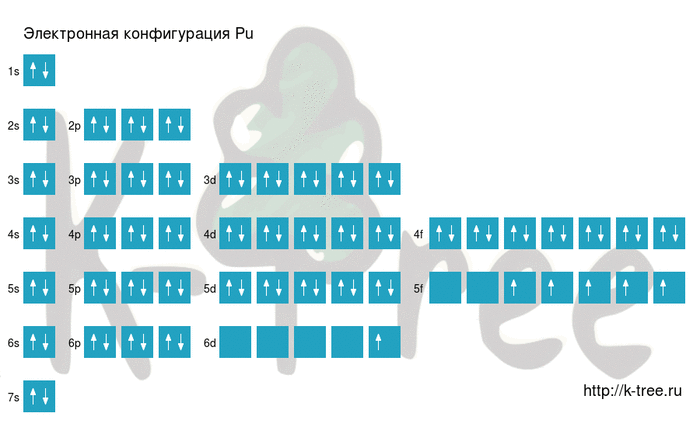Плутоний (элемент)
В таблице справа приведены основные свойства α-Pu — основной аллотропной модификации плутония при комнатной температуре и нормальном давлении.
Содержание
История
Изотоп плутония 238 Pu впервые искусственно получен 23.02.1941 года группой американских ученых во главе с Г. Сиборгом путем облучения ядер урана дейтронами. Примечательно, что только после искусственного получения плутоний был обнаружен в природе: в ничтожно малых количествах 239 Pu обычно содержится в урановых рудах как продукт радиоактивного превращения урана.
Нахождение в природе
В урановых рудах в результате захвата нейтронов (например, нейтронов из космического излучения) ядрами урана образуется нептуний ( 239 Np), продуктом β-распада которого и является природный плутоний-239. Однако плутоний образуется в таких микроскопических количествах (0,4—15 частей Pu на 10 12 частей U), что о его добыче из урановых руд не может быть и речи.
Происхождение названия
Физические свойства
Этот изотоп используется почти исключительно в РИТЭГ космического назначения, например, на всех аппаратах, улетавших дальше орбиты Марса.
Эти три изотопа серьёзного промышленного значения не имеют, но получаются, как побочные продукты, при получении энергии в ядерных реакторах на уране, путём последовательного захвата нескольких нейтронов ядрами урана-238. Изотоп 242 по ядерным свойствам наиболее похож на уран-238. Америций-241, получавшийся при распаде изотопа 241, использовался в детекторах дыма.
Плутоний интересен тем, что от температуры затвердевания до комнатной претерпевает шесть фазовых переходов, больше, чем любой другой химический элемент. При последнем плотность увеличивается скачком на 11%, в результате, отливки из плутония растрескиваются. Стабильной при комнатной температуре является альфа-фаза, характеристики которой и приведены в таблице. Для применения более удобной является дельта-фаза, имеющая меньшую плотность, и кубическую объёмно-центрированную решётку. Плутоний в дельта-фазе весьма пластичен, в то время, как альфа-фаза хрупкая. Для стабилизации плутония в дельта-фазе применяется легирование трёхвалентными металлами (в первых ядерных зарядах использовался галлий).
Применение
Биологическая роль
Плутоний высокотоксичен; ПДК для 239 Pu в открытых водоемах и воздухе рабочих помещений составляет соответственно 81,4 и 3,3*10 −5 Бк/л. Большинство изотопов плутония обладают высокой величиной плотности ионизации и малой длиной пробега частиц, поэтому его токсичность обусловлена не столько его химическими свойствами (вероятно, в этом отношении плутоний токсичен не более, чем другие тяжелые металлы), сколько ионизирующим действием на окружающие ткани организма. Плутоний относится к группе элементов с особо высокой радиотоксичностью. В организме плутоний производит большие необратимые изменения в скелете, печени, селезенке, почках, вызывает рак. Максимально допустимое содержание плутония в организме не должно превышать десятых долей микрограмма.
Плутоний Pu
Плутоний в таблице менделеева занимает 94 место, в 9 периоде.
| Символ | Pu |
| Номер | 94 |
| Атомный вес | Нестабилен |
| Латинское название | Plutonium |
| Русское название | Плутоний |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
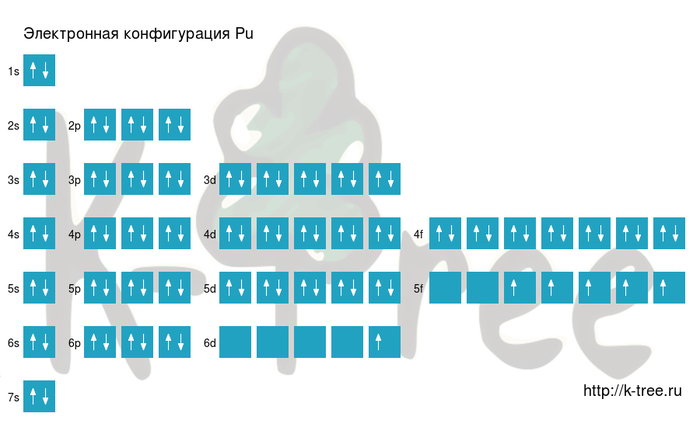
Электронная схема плутония
Pu: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1
Короткая запись:
Pu: [Xe]6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1
Порядок заполнения оболочек атома плутония (Pu) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Плутоний имеет 94 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
10 электронов на 5d-подуровне
6 электронов на 6p-подуровне
2 электрона на 7s-подуровне
5 электронов на 5f-подуровне
1 электрон на 6d-подуровне
Степень окисления плутония
Атомы плутония в соединениях имеют степени окисления 7, 6, 5, 4, 3, 2.
Ионы плутония
Валентность Pu
Атомы плутония в соединениях проявляют валентность VII, VI, V, IV, III, II.
Валентность плутония характеризует способность атома Pu к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Pu
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Плутоний. Описание плутония. Свойства плутония
Описание плутония
Плутоний (Plutonium) представляет собой тяжелый химический элемент серебристого цвета, радиоактивный металл с атомным числом 94, который в периодической таблице Менделеева обозначается символом Pu.
Данный электроотрицательный активный химический элемент относится к группе актиноидов с атомной массой 244,0642, и, как и нептуний, который получил свое название в честь одноименной планеты, своим названием этот химический обязан планете Плутон, поскольку предшественниками радиоактивного элемента в периодической таблице химических элементов Менделеева является уран и нептуний, которые также были названы в честь далеких космических планет нашей Галактики.
Происхождение плутония
Элемент плутоний впервые был открыт в 1940 году в Калифорнийском Университете группой ученых-радиологов и научных исследователей Г. Сиборгом, Э. Макмилланом, Кеннеди, А. Уолхом при бомбардировании урановой мишени из циклотрона дейтронами — ядрами тяжелого водорода.
В декабре того же года учеными был открыт изотоп плутония – Pu-238, период полураспада которого составляет более 90 лет, при этом было установлено, что под воздействием сложнейших ядерных химических реакций изначально получается изотоп нептуний-238, после чего уже происходит образование изотопа плутония-238.
В начале 1941 года ученые открыли плутоний 239 с периодом распада в 25 000 лет. Изотопы плутония могут иметь различное содержание нейтронов в ядре.
Чистое соединение элемента смогли получить только в конце 1942. Каждый раз, когда ученые-радиологи открывали новый изотоп, они всегда измеряли время периодов полураспада изотопов.
В настоящий момент изотопы плутония, которых всего насчитывается 15, отличаются по времени продолжительности периода полураспада. Именно с этим элементом связаны большие надежды, перспективы, но и в тот же момент, серьезные опасения человечества.
Плутоний имеет значительно большую активность, чем, к примеру, уран и принадлежит к самым дорогостоящим технически важным и значимым веществам химической природы.
Производство, добыча плутония считается затратной, а стоимость одного грамма металла в наше время уверенно держится на отметке в 4000 американских долларов.
Как получают плутоний? Производство плутония
Производство химического элемента происходит в атомных реакторах, внутри которых уран расщепляется под воздействием сложных химическо-технологических взаимосвязанных процессов.
Уран и плутоний являются главными, основными компонентами при производстве атомного (ядерного) горючего.
При необходимости получения большого количества радиоактивного элемента применяют метод облучения трансурановых элементов, которые можно получить из отработанного атомного топлива и облучения урана. Протекание сложных химических реакций позволяет отделить металл от урана.
Чтобы получить изотопы, а именно плутоний-238 и оружейный плутоний-239, которые представляют собой промежуточные продукты распада, используют облучение нептуния-237 нейтронами.
Ничтожно малую часть плутония-244, который является самым «долгоживущим» вариантом изотопа, по причине его длительного периода полураспада, обнаружили при исследованиях в цериевой руде, которая, скорее всего, сохранилась с момента формирования нашей Планеты Земля. В естественном виде в природе данный радиоактивный элемент не встречается.
Основные физические свойства и характеристики плутония
Плутоний — довольно тяжелый радиоактивный химический элемент серебристого цвета, который блестит только в очищенном виде. Атомная масса металла плутоний равна 244 а. е. м.
По причине своей высокой радиоактивности данный элемент теплый на ощупь, может разогреться до температуры, которая превышает температурный показатель при кипении воды.
Плутоний, под воздействием атомов кислорода быстро темнеет и покрывается радужной тонкой пленочкой изначально светло-желтого, а затем насыщенного красно — коричневого или бурого оттенка.
При сильном окислении происходит образование на поверхности элемента изумрудно — желтого порошка PuO2. Данный вид химического металла подвержен сильным процессам окисления и воздействия коррозии даже при незначительном уровне влажности.
Соли металла быстро нейтрализуются в средах с нейтральной реакцией, щелочных растворах, при этом образовывая нерастворимый гидрооксид плутония.
Температура, при которой происходит плавление плутония равна 641 градусам Цельсия, температура кипения – 3230 градусов.
Под воздействием высоких температурных режимов происходят неестественные изменения плотности металла. В твердом виде плутоний обладает различными фазами, имеет шесть кристаллических структур.
При расплавлении происходит сильное сжатие элемента, поэтому металл может держаться на поверхности воды и других неагрессивных жидких сред.
Несмотря на то, что данный радиоактивный элемент принадлежит к группе химических металлов, элемент довольно летуч, и при нахождении в закрытом пространстве за непродолжительный период времени увеличивается и возрастает в несколько раз его концентрация в воздухе.
К основным физическим свойствам металла можно отнести: невысокую степень, уровень теплопроводности из всех существующих и известных химических элементов, низкий уровень электропроводности, в жидком состоянии плутоний относится к одним из наиболее вязких металлов.
Стоит отметить, что любые соединения плутония относятся к токсичным, ядовитым и представляют серьезную опасность облучения для человеческого организма, которое происходит по причине активного альфа-излучения, поэтому все работы нужно выполнять предельно внимательно и только в специальных костюмах с химической защитой.
Больше о свойствах, теориях происхождения уникального металла можно прочитать в книге Обручева «Плутония». Автор В.А. Обручев приглашает читателей окунуться в удивительный и уникальный мир фантастической страны Плутония, которая расположена в глубине недр Земли.
Применение плутония
Промышленный химический элемент принято классифицировать на оружейный и реакторный («энергетический») плутоний.
Так, для производства ядерного вооружения из всех существующих изотопов допустимо применять только плутоний 239, в котором не должно быть более 4.5% плутония 240, так как он подвержен самопроизвольному делению, что значительно затрудняет изготовление боевых снарядов.
Плутоний-238 находит применение для функционирования малогабаритных радиоизотопных источников электрической энергии, к примеру, в качестве источника энергии для космической техники.
Несколько десятилетий тому назад плутоний применяли в медицине в кардиостимуляторах (приборы для поддержания сердечного ритма).
Если провести сравнение ядерного плутония с чистым металлом, изотоп обладает более высокими металлическими параметрами, не имеет фаз перехода, поэтому его широко используют в процессе получения элементов топлива.
Оксиды изотопа Плутония 242 также востребованы как источник питания для космических летальных агрегатов, техники, в ТВЭЛах.
Оружейный плутоний – это элемент, который представлен в виде компактного металла, в котором содержится не меньше 93% изотопа Pu239.
Данный вид радиоактивного металла применяют про производстве различных видов ядерного оружения.
Получают оружейный плутоний в специализированных промышленных атомных реакторах, которые функционируют на природном или на низкообогащенном уране, в результате захвата им нейтронов.
Плутоний, свойства атома, химические и физические свойства
Плутоний, свойства атома, химические и физические свойства.
244,0642 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 5f 6 6s 2 6p 6 7s 2
Плутоний — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 94. Расположен в 3-й группе (по старой классификации — побочной подгруппе третьей группы), седьмом периоде периодической системы. Относится к группе актиноидов.
Атом и молекула плутония. Формула плутония. Строение атома плутония:
Плутоний обозначается символом Pu.
Изотопы и модификации плутония:
Свойства плутония (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Плутоний |
| 102 | Прежнее название | |
| 103 | Латинское название | Plutonium |
| 104 | Английское название | Plutonium |
| 105 | Символ | Pu |
| 106 | Атомный номер (номер в таблице) | 94 |
| 107 | Тип | Металл |
| 108 | Группа | Актиноид. Переходный, радиоактивный металл. Трансурановый элемент |
| 109 | Открыт | Гленн Теодор Сиборг, Артур Валь, Джозеф Уильям Кеннеди и Эдвин Маттисон Макмиллан, США, май 1940 г. |
| 110 | Год открытия | 1940 г. |
| 111 | Внешний вид и пр. | Тяжёлый, хрупкий, радиоактивный металл серебристо-белого цвета. Тёплый на ощупь. Радиотоксичен |
| 112 | Происхождение | Получен путем синтеза |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 7 аллотропных модификаций: – ζ-плутоний |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0 %. В земной коре встречается в следовых количествах |
| 120 | Содержание в морях и океанах (по массе) | 0 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0 % |
| 122 | Содержание в Солнце (по массе) | 0 % |
| 123 | Содержание в метеоритах (по массе) | 0 % |
| 124 | Содержание в организме человека (по массе) | 0 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 244,0642 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 5f 6 6s 2 6p 6 7s 2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O24 P8 Q2 R0 |
| 204 | Радиус атома (вычисленный) | |
| 205 | Эмпирический радиус атома* | 151 |
| 206 | Ковалентный радиус* | 187пм |
| 207 | Радиус иона (кристаллический) | Pu 3+ 16,63 г/см 3 (при температуре плавления 639,4 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 639,4 °C (912,5 K, 1182,9 °F) |
| 403 | Температура кипения* | 3228 °C (3505 K, 5842 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,82 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 333,5 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 35,5 Дж/(K·моль) |
| 411 | Молярный объём | 12,12 см³/моль |
| 412 | Теплопроводность | 6,74 Вт/(м·К) (при стандартных условиях ), 6,74 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-плутоний |
| 512 | Структура решётки | Моноклинная |
| 513 | Параметры решётки | a = 6,183 Å, b = 4,822 Å, c = 10,963 Å, β = 101,8° |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 162 K |
| 516 | Название пространственной группы симметрии | P121/m1 |
| 517 | Номер пространственной группы симметрии | 11 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-07-5 |
205* Эмпирический радиус атома плутония согласно [1] и [3] составляет 159 пм и 162 пм соответственно.
206* Ковалентный радиус плутония согласно [1] составляет 187±1 пм.
401* Плотность всех аллотропных модификаций плутония согласно [3] варьируется от 15,9 г/см 3 до 19,86 г/см 3 (состояние вещества – твердое тело).
402* Температура плавления плутония согласно [3] и [4] составляет 639,7 °C (912 K, 1182 °F) и 640 °C (913,15 K, 1184 °F) соответственно.
403* Температура кипения плутония согласно [3] и [4] составляет 3235 °C (3507 K, 5855 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) плутония согласно [3] и [4] составляет 2,8 кДж/моль и 2,824 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) плутония согласно [3] и [4] составляет 343,5 кДж/моль и 351 кДж/моль соответственно.
410* Молярная теплоемкость плутония согласно [3] составляет 32,77 Дж/(K·моль).